Accueil > Nos Actions > Références & Supports > Articles scientifiques et petits essais > Ecosystèmes et biodiversité > Chenille processionnaire du pin : La longue procession de Thaumetopoea pityocampa
Introduction
Les chenilles processionnaires du pin, Thaumetopoea pityocampa, sont déjà omniprésentes dans le sud de l’Europe et au nord de l’Afrique. Facilement notable par leur nid formé de soie dans les pins et cèdres, elles se retrouvent aussi bien en milieu forestier et urbain. Profitant du réchauffement climatique, cette espèce opportuniste continue son expansion vers le nord de l’Europe. Seulement celle-ci est urticante et présente un risque sanitaire pour l’homme et les animaux domestiques. De plus c’est un des ravageurs les plus nocifs pour les pins et les cèdres, ce qui entraine des répercussions écologiques et économiques. Les scientifiques recherchent ainsi des moyens de lutte contre T pityocampa qui dans l’avenir pourrait être se répandre dans toute l’Europe et éventuellement conquérir de nouveaux continents.
Le Projet
A la conquête de territoires
Il n’est pas rare de croiser au détour de balades en forêt, ou même, sur les bords de route, des masses de soie blanche au sein de pins, voir de cèdres. Il s’agit de nids de chenilles processionnaires Thaumetopoea pityocampa.
Espèce opportuniste, grégaire et polymorphe. Elle se propage facilement grâce à sa bonne capacité d’adaptation mais aussi grâce au réchauffement climatique.
Par analyse génétique, il a été possible de démontrer la présence de chenilles processionnaires en Europe, dès le tertiaire.
Elles ont pu survivre aux périodes de glaciation du quaternaire grâce à quatre principales zones refuges (situées en Espagne et en Italie) qui furent dépourvues de glace.
A partir de ces zones elle ont pu rapidement reconquérir le bassin méditerranéen.
(voir lien ci-joint pour sa répartition géographie actuelle) https://gd.eppo.int/taxon/THAUPI/di...
Le climat tempéré et les hivers doux ont été favorables à sa propagation.
Les capacités de survie de T.pityocampa
Les chenilles processionnaires sont sensibles aux variations de température car leur croissance et leur développement se font surtout en hiver.
Le climat est ainsi un paramètre clef de l’avancé du ravageur.
Elles survivent facilement à l’hiver grâce à leurs nids : composés de couches de soie isolante, ils agissent comme de véritables capteurs solaires, la température intérieure sera considérablement plus chaude qu’à l’extérieur.
Ainsi elles peuvent résister à des températures pouvant aller jusqu’à -16 degrés. Néanmoins une longue période de froid (environ -10°) les empêchera de s’alimenter la nuit et les mènera à leur perte.
Cependant une longue période de froid n’aboutira pas forcement à l’extinction locale de la chenille processionnaire.
En effet lors de leur cycle biologique, les chenilles s’enterrent pour entrer en léthargie sous forme de chrysalide, puis se transforment en papillon. Ce cycle dure normalement une année. Seulement les chenilles processionnaires du pin vont être capables de prolonger cette léthargie sous forme de chrysalide pour boucler leur cycle (le cycle biologique de T pityocampa se fait sur 2 ans pour des colonies localisées en Corse, soumises à des températures plus froides).
Ce processus nommé diapause peut être encore prolongé sur plusieurs années (5 à 9 ans) pour leur permettre de survivre si les conditions sont défavorables (conditions climatiques ou manque de nourriture).
Même si des colonies meurent dues aux conditions climatiques létales ou au manque de nourriture, d’autres survivront sous forme de chrysalides et pourront réémerger lorsque les conditions seront redevenus favorables (Toffolo et al.,2006).
Elles ont également su adapter la phénologie de leur cycle biologique en fonction des conditions environnementales de leur propre régions.
Par exemple, les imagos adultes émergent en automne au sud de leur espaces territorial et à faible altitude afin d’éviter les hautes températures estivales. Tandis qu’ils émergent en été dans les régions plus au nord et à une altitude plus élevée, afin de profiter de températures estivales modérées .
Le vivier de nourriture de T.pityocampa
Les chenilles processionnaires se nourrissent de préférence sur les pins noirs. Étant une espèce opportuniste elles ont su adapter leur alimentation en fonction de leur nouvelle expansion. Grâce à leurs impressionnantes griffes elles ont prise sur tout types d’aiguilles. Elles ont pu coloniser de nouveaux hôtes comme Pinus mugo qui était auparavant un hôte occasionnel (Toffolo et al.,2006). Celles-ci peuvent désormais coloniser de nombreux types de pin (Pinus pynaster, halopensis, brutia, sylvestris...) et même de cèdre (Cedrus libani, atlantica ..).
Toutes les tranches d’âge d’arbre seront concernées, les jeunes chenilles se nourriront de préférence d’aiguilles matures et en grandissant pourront s’attaquer aux aiguilles plus juvéniles. Celles-ci mangent la nuit, leur permettant d’éviter de nombreux prédateurs.
Le choix du pins n’étant pas un facteur limitant, l’expansion des chenilles processionnaires ne se cantonnera pas à l’aire de répartition d’une essence de pin précise.
Les moyens d’expansions de T pityocampa
T pityocampa est une espèce polymorphe, passant de chenille à papillon en passant par le stade de chrysalide. Elle va surtout étendre son territoire grâce à son dernier stade.
En effet, l’imago de T pityocampa n’étant plus cantonné à son stade de chenille, peut se déplacer plus aisément par les airs.
Si les processions de chenilles peuvent effectuer environ 40 mètres, l’imago mâle peut effectuer jusqu’à 15 Km, ce qui lui permet de trouver une femelle, de maintenir un brassage chromosomique décent et ainsi d’assurer la descendance. L’imago femelle, elle, peut parcourir jusqu’à deux kilomètres, pour trouver un hôte et y pondre (de 70 à 300 œufs !). Elle favorisera un pin bien ensoleillé pour que la prochaine génération s’épanouisse dans des conditions environnementales optimales. Les pins isolés, cimes des arbres ou lisières de forêt seront d’autant plus privilégiés.
T pityocampa a ainsi un fort potentiel de fécondité et de reproduction.
L’expansion géographique dépend donc de l’imago femelle, il suffit que le pin à coloniser se trouve dans une aire de deux kilomètres de distance de l’imago femelle pour que la progression soit assurée.
Les pins sont fortement disséminés en Europe, que ce soit sous forme de forêts ou isolés.
Des plantations massives de pins en Europe durant ce dernier siècle ont favorisé l’expansion du ravageur.
En France par exemple, le pin est omniprésent.
Une large forêt homogène et dense, ayant des individus du même âges et de la même essence, espacés les uns des autres de façon régulière, est un habitat très propice aux chenilles processionnaires.(Hodar et al.,2004)
Cette dissémination a été également induite fortement par l’homme en milieu urbain (parcs, jardin, bords de route).
Cela a aidé la progression de T pityocampa à des endroits géographique où les pinèdes étaient absentes.
Les pins étant présents jusqu’à 2200 m d’altitude, elles ont pu également franchir des barrières géographiques comme des montagnes.
Le réchauffement climatique s’allie à T pityocampa
Depuis le début du vingtième siècle, elles ont commencé à étendre leur répartition géographique vers le nord.
L’expansion de la chenille processionnaire du pin coïncide avec le réchauffement climatique.
Les températures minimales hivernales sont en hausse depuis les années 1990. Or ces années ont été un période d’expansion pour les chenilles processionnaires du pin.
En France elle ont ainsi passé la Loire, atteint la Bretagne et l’île de France, comme on peut le voir sur la carte ci-dessous.
Elles ont pu ainsi atteindre des zones devenues favorables : elles ont progressé en latitude et en altitude (Battisti et al.,2005).
Cette expansion a été particulièrement remarquable en 2003 dans les alpes italiennes
Cet été là fut un des plus chaud de ces dernières 500 années en Europe. Ce phénomène est attribuée à une dispersion nocturne accrue des femelles. Le réchauffement a permis le maintien de la présence des chenilles dans cette région due à une meilleur survie de la larve (Battisti et al.2006).
Une procession pas catholique
Vers la fin de l’été, les chenilles processionnaires fraîchement éclos, vont former leur nids, essentiellement sur les pins mais également sur des cèdres, elles y passeront l’hiver, se nourrissant la nuit des aiguilles de l’arbre.
Au printemps lors de journées ensoleillées, les colonies de chenilles processionnaires quittent leurs nids par procession, elles se suivent les unes les autres en file indienne. Lorsque celles-ci ont trouvé un sol meuble et bien ensoleillé, elles s’enterrent pour devenir chrysalide et ainsi commencer leur transformation en papillon.
Lors de leur procession, elles sont vulnérables, ainsi ont-elles développé un mécanisme de défense drastique. Lorsque elles se sentent menacées ou stressées, elles libèrent des poils qui contiennent une substance appelée « thaumétopoéïne » .
Au contact de leur cible ses poils, se cassent et libèrent cette protéine urticante, nocive pour les éventuelles prédateurs.
Ces poils sont également urticants et allergènes pour l’homme et les animaux, de plus ils restent dangereux plusieurs mois.
Étant très volatiles, ils se répandent facilement dans l’air, il suffit d’être à proximité d’un nid (qui amasse de nombreux poils urticant) ou de procession de Thaumetopoea pityocampa pour être exposé au contact de ces poils.
Dans les régions occupées par ces chenilles processionnaires, elles sont présentes aussi bien en forêt qu’en milieu urbain (parc, jardins, aires d’autoroutes...), ce qui pose ainsi un sérieux problème sanitaire.
Impact sur l’homme
Ce sont durant les derniers mois d’hiver et au printemps que le risque d’être exposé au poils des chenilles processionnaires est important.
Au contact de la bouche, de la tête ou du cou, ils peuvent entraîner - même chez les personnes non allergique - démangeaisons, conjonctivites, éruptions douloureuses et asthme mais également des réactions locales plus graves pouvant aboutir à des congestions des voies respiratoire (Verriera et al.,2015) et éventuellement provoquer un choc anaphylactique..
Ainsi dans le pire des cas les chenilles processionnaires peuvent mener à l’hospitalisation.
Impact sur les animaux
Les animaux domestiques peuvent être également atteints.
Ce sont les chiens les plus touchés allant d’une simple inflammation buccale jusqu’à la perte partielle de la langue.
Les ruminants peuvent présenter certaines lésions pouvant ressembler à celles liées aux virus de la fièvre aphteuse ou de la fièvre catarrhale ovine.
Impact sur les arbres
Les chenilles processionnaires du pin représentent l’un des ravageurs les plus nocif pour les pins et les cèdres dans la plupart des pays méditerranéens.
En effet, leurs aiguilles sont la source principale de nourriture pour les chenilles.
Elles sont particulièrement voraces l’hiver lorsqu’elles ont crée leur nid.
En un mois, quatre à cinq nids suffisent pour défolier un arbre dans sa totalité.
Ce qui fait également de Thaumetopoea pityocampa un des défoliateurs principal du pin et du cèdre.
Ces défoliations sont cycliques et sévères, elles durent plusieurs années, et lorsqu’une parcelle de pin ou de cèdre sera majoritairement défoliée, les chenilles processionnaires attendront leur régénération, pour de nouveau lancer leur épidémie.
Cette défoliation peut entraîner en plus d’une dévalue esthétique, une réduction de l’accroissement de l’arbre (croissance radiale et croissance en hauteur), accroître une situation de stress, (thermique ou hydrique) mais aussi induire un affaiblissement pouvant être exploité par des parasites secondaires (scolytes, charançon du pin, pissodes...).
Cela s’explique par le manque d’aiguilles et donc une réduction de l’activité photosynthétique de l’arbre. L’arbre aura ainsi moins d’énergie pour lutter contre les parasites, un stress ou pour réaliser sa croissance. Si cette défoliation perdure sur plusieurs années l’arbre peut être amené à dépérir.
Même si les morts sont rares, la baisse de leur accroissement mènent à des répercussions économiques non négligeables.
En effet suite à une sévère attaque, on observe une diminution de croissances annuelles les années suivantes (Laurent-Hervouet N.,2002)
Cette diminution de la croissance touche autant la croissance en diamètre que la croissance en hauteur de l’arbre (Jacquet et al.,2012).
Pour avoir un ordre d’idée, une diminution allant jusqu’à 35% de la croissance radial annuelle, et une diminution d’environ 45% du volume total des arbres a déjà été constaté sur des essences de Pinus nigra (Bouchon & Toth, 1971) .
Il a été démontré que le pourcentage de diminution de l’accroissement du diamètre annuel est directement proportionnel aux nids présents sur l’arbre (Kanat et al.,2005).
Cela dépendra donc de la région, (suivant les températures/ensoleillement les chenilles seront plus ou moins nombreuses), des essences d’arbres, (le pin noir est plus attaqué que les autres essences) et de l’âge (les jeunes individus seront plus sensibles à ces effets car le jeune feuillage contribue essentiellement à la croissance de l’arbre (Battisti et al.,2005), de plus celui-ci sera plus rapidement consommé).
Associé à un stress environnemental, ces diminutions de croissance peuvent être accentuées et d’autres effets peuvent être provoqués. Le manque de photosynthèse en étant encore la cause.
Par exemple, il a été démontré que la défoliation de T pityocampa additionnée au stress thermique, a des conséquences sur la capacité de reproduction des pins P sylvestris subsp. Nevadensis (Hodar et al.,2002).
Ces pins qui subissent le réchauffement climatique et l’infestation des chenilles processionnaires, produisent des graines plus légères et en plus petite quantité ainsi que des cônes plus petits en plus petite quantité. La régénération des pinèdes est ainsi fragilisée et plus longue : moins de plants seront susceptibles de voir le jour. De plus ceux-ci mettront plus de temps pour croître. Ils seront ainsi vulnérables plus longtemps aux herbivores et mettront plus de temps à atteindre un stade de reproduction.
La guerre est déclarée
Suite à leur impact économique important, le problème sanitaire qu’elles induisent et leur inexorable expansion géographique, les scientifiques recherchent activement des systèmes de lutte contre la chenille processionnaire.
Des traitements microbiologiques, à base de Bacillus thuringiensis kurstaki (BtK )et chimiques existent, mais ces traitements ne sont pas écologiques.
Des techniques mécaniques existent mais celles-ci sont irréalisables à grande échelle.
Les scientifiques travaillent ainsi sur des alternatives de lutte plus efficaces et respectueuses de l’environnement afin de suivre les directives du plan écophyto 2018 et de ne pas utiliser de produits phytosanitaires.
Ainsi des pièges à chenilles existent, basés sur le blocage de la procession des chenilles (gouttière encerclant l’arbre infecté), ou sur le piégeage des imagos.
Ce dernier comporte des phéromones semblables à celles émises par l’imago femelle pour attirer les mâles dans un piège. Sur le même principe un diffuseur de phéromone est expérimenté, afin d’entrainer la confusion sexuel de T pityocampa.
Une lutte biologique peut être également mis en place consistant à installer des nichoirs pour les prédateurs naturels des chenilles processionnaires (huppe, mésange charbonnière... ), ou encore à effectuer des lâchers de parasites oophages.
Suivant les zones à éradiquer (milieu forestiers/urbains), différents méthodes peuvent être utilisées.
En milieu urbain où le risque est grands (école,parc), certains arbres infestés seront jusqu’à être abattus. Les zones étant plus restreintes les traitements mécaniques et de piégeage combinés seront efficaces. Un piégeage des chenilles en hiver et des imagos en été est une solution efficace de lutte.
Pour les zones où la présence de T pityocampa est tolérée, la pose de nichoir et de pièges est amplement suffisant .
Pour protéger un maximum les forêts de pins ou de cèdres, une solution a été émise consistant à augmenter la diversification et communautés des espèces à proximité des pinèdes afin de lutter contre les défoliations à répétition de T pityocampa (Hodar et al.,2002)
L’INRA a mis en avant qu’une pinède camouflée par la présence de feuillus limite l’infestation de ladite pinède par le ravageur. Ce stratagème repose sur le sens olfactif très développé des chenilles processionnaires. L’odeur des feuillus les repousserait.
De plus les feuillus sont les hôtes d’ennemis naturels des chenilles processionnaires comme l’épiphigere ou la mésange charbonnière.
A partir de cette étude, l’INRA a mis en place une expérimentation basée sur la diffusion d’un composé olfactif de bouleau, pouvant être diffusé dans les parcs et jardins afin de repousser T pityocampa
Un futur inquiétant
Le réchauffement climatique va avoir pour conséquence des températures de plus en plus élevées et des hivers de plus en plus doux.
Cela favorisera le temps d’alimentation de T phitocampa et diminuera le risque de température létale pour cette espèce (Battisti et al.,2005).
La fréquence et l’ intensité des sévères défoliations provoquées par les chenilles processionnaires augmenteront avec le réchauffement des températures hivernales. L’addition du stress induit par le réchauffement climatique et du stress lié à l’infestation de T pityocampa pourra engendrer de lourdes conséquences sur les arbres.
Les essences de pins seront amener à épuiser leurs réserves énergétique, ce qui causera une diminution encore plus accrue de l’accroissement des arbres infectés et pourra engendrer d’autres conséquences comme (à l’instar du Pinus sylvestris nevadansis) une réduction de la production de graines et une réduction de la régénération naturelle. Le réchauffement climatique limitera également les capacités de défense des hôtes contre les autres facteurs comme la sécheresse ou autres conditions climatiques défavorables, accélérant leur mortalité (Hodar,2004).
Ainsi des populations tel que Cedrus atlatica mineti qui résistent pour l’instant aux chenilles processionnaires seront probablement destinées à décliner face à l’addition du stress induit par le réchauffement climatique. (Sbadji et al., 2015)
Vu que la distribution de ses hôtes est propice à son expansion, seuls les hivers rigoureux était jusque là les facteurs limitant la répartition de T Pitycocampa
Avec le réchauffement des températures, les chances de survie des chenilles et ses capacités de reproduction augmenteront (Robinet et al.2013). Elles pourront alors atteindre des latitudes et des altitudes plus élevées (Battisti et al.,2005) (altitudes qui coïnciderait avec la distribution de pins sylvestre (Hodar et al.,2002). La chenille processionnaire du pin se répandra ainsi vers le nord de l’Europe mais aussi dans des zones auparavant hostiles à ce ravageur. Cette expansion pourrait être d’autant plus rapide que les températures élevées favorisent les déplacements des imagos, permettant une plus large expansion de son territoire.
On connaît mal les températures létales maximum pour T pityocampa, cependant de hautes températures (40°) n’affecteraient pas les œufs et les adultes. Les jeunes larves - très sensibles aux hautes températures- pourraient elles, être affectées directement ou indirectement. Les expositions répétées à de fortes vagues de chaleurs pourrait ainsi diminuer leur abondance (Robinet et al.,2013).
Mais là encore on pourra s’attendre à ce que la chenille processionnaire adapte la phénologie de leurs cycles biologiques afin de survivre aux conditions climatiques.
Voici l’expansion attendue de T pityocampa en Europe en fonction des éventuels scénarios du réchauffement climatique.
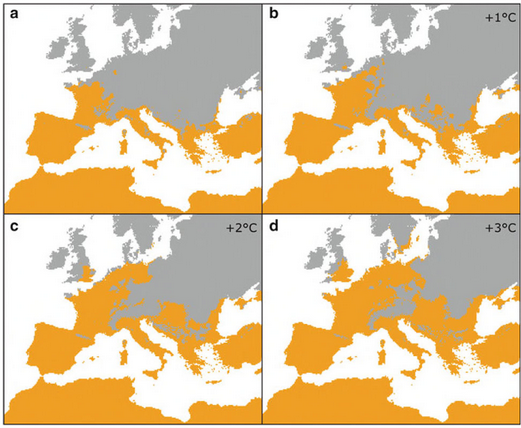
- Expansion attendue de T pityocampa en Europe en fonction du réchauffement climatique
Ainsi en fonction du réchauffement climatique et grâce à leur capacité d’adaptation et leur grand potentiel de reproduction, les chenilles processionnaires pourraient être omniprésentes en Europe dans les années à venir.
Mais l’Europe sera t’elle sa dernière conquête ?
Sur le globe de nombreuses zones correspondraient à leur environnement naturel
Ainsi d’éventuels déplacements accidentels dans le cadre d’échanges intercontinentaux pourraient amplifier leur propagation au niveau mondial. Ces déplacements pourraient très bien arriver lorsque celles-ci se retrouvent dans leur état de chrysalide enterrée sous terre. Si un pin qui contient une chrysalide dans ses racines est exporté, l’expansion de T pityocampa continuera à l’étranger.
Elle pourrait ainsi devenir, une espèce invasive.
Références
Andrea Battisti, Michael Stastny, Sigrid Nethrer, Christelle Robinet, Axel Shopf, Alain Roques, Stig Larsson (2005). Expansion of geographic range in the pine processionary moth caused by increased winter temperatures [Version électronique].
Andrea Battisti, Michael Stastny, Emiliano Buffo, Stig Larsson (2006). A rapid altitudinal range expansion in the pine processionary moth produced by the 2003 climatic anomaly [Version électronique].
J. Bouchon, J. Toth (1971). Etude préliminaire sur les pertes de production des pinèdes soumises aux attaques de la Processionnaire du Pinb Thaumetopoea pityocampa Schiff [Version électronique].
José A. Hodar, Jorge Castro, Regino Zamora (2002). Pine processionary caterpillar
Thaumetopoea pityocampa as a new threat for relict Mediterranean Scots pine forests under climatic warming [Version électronique].
José A Hodar, Regino Zamora (2004). Herbivory and climatic warming : a Mediterranean outbreaking caterpillar attacks a relict, boreal pine species [Version électronique].
Jacquet, Orazio, Jactel (2012). Defoliation by processionary moth signicantly reduces
tree growth : a quantitative review [Version électronique].
Mehmet Kanat, M. Hakki Alma, Fatih Sivrikaya (2005). Effect of defoliation by Thaumetopoea pityocampa (Den.& Schiff.) (Lepidoptera : Thaumetopoeidae) on annual diameter increment of Pinus brutia Ten. in Turkey [Version électronique].
Laurent-Hervouet N.,(1986). Mesure des pertes de croissance radiale sur quelques espèces de Pinus dues à deux défoliateurs forestiers. I.
Cas de la processionnaire du pin en région méditerranéenne [Version électronique].
Edoardo Petrucco Toffolo, Iris Bernardinelli, Fabio Stergulc, Andrea Battisti (2006) Climate change and expansion of the pine processionary moth, thaumetopoea pityocampa, in northern italy [Version électronique].
Christelle Robinet, Jérôme Rousselet, Patrick Pineau, Florie Miard, Alain Roques (2013) Are heat waves susceptible to mitigate the expansion of a species progressing with global warming ?[Version électronique].
Mohamed Sbabdji, Luc Lambs, Ahmed Haddad & Bachir Kadik,(2015). Effect of periodic defoliations by thaumetopoea pityocampa schiff. on radial growth in cedar woodland in chréa, algeria [Version électronique].
Esther Casado Verriera, Miguel A. Carro Rodrígueza, María de la Parte Canchoa,
Roi Piñeiro Pérez (2015).Reacción sistémica tras la ingesta de una oruga procesionaria
del pino. ¿Manejo conservador ?
Systemic reaction after pine processionary caterpillar ingestion. Conservative
management ? [Version électronique].












